Propuesta para el uso de bromeliáceas epífitas como bioindicadoras del efecto de cambio global en los ecosistemas de la península de Yucatán
Proposal for the Use of Epiphytic Bromeliads as Bioindicators of the Effect of Global Change in the Yucatan Peninsula
Casandra Reyes García,* Celene Espadas Manrique,* Manuela Tamayo Chim,* Juan Pablo Pinzón Esquivel,** Nahlleli Chilpa Galván,* Manuel J. Cach Pérez,*** José Luis Andrade* y Roger Orellana*
* Centro de Investigación Científica de Yucatán (CICY), creyes@cicy.mx, uhkin@cicy.mx, manuelatamayo@hotmail.com, nahlleli.civi@gmail.com y andrade@cicy.mx, rogeraaol@gmail.com, respectivamente.
** Universidad Autónoma de Yucatán (UADY), juan.pinzone@correo.uady.mx.
*** El Colegio de la Frontera Sur, Unidad Villahermosa, mcach@ecosur.mx.
Nota: dedicado a la memoria del Biól. Arturo Victoria Hernández†, colaborador del proyecto, el cual fue financiado por CONACYT-INEGI 290916 y el CICY; asimismo, se agradece tanto a la Reserva de la Biósfera Calakmul-CONANP, INAH-Campeche, INAH-Yucatán, Reserva Biocultural Kaxil-Kiuic y Reserva de la Biósfera Celestún como el apoyo de Roberth Us Santamaría, Luis Simá Gómez, Filogonio May-Pat, José L. Tapia-Muñoz, Agatha Rosado-Calderón, Evert Pat, Stephany Peniche, Harry Moreno, Kiyoco Moreno, Susana Dzib, Guillermo Sánchez, David-Pérez, Karen Solís, Jazmín Cervera, José Carlos Rosas-Mejía y Alfredo Dorantes-Euan.
Vol. 14, Núm. 3- Epub Propuesta para el uso...- Epub
|
La península de Yucatán comprende el continuo de selva tropical más conservada de México y uno de los acuíferos de karst más extensos del mundo. En el presente trabajo proponemos monitorear la salud de los ecosistemas de esta zona geográfica utilizando los grupos funcionales (tanques CAM, C3 y somero, así como nebulofitas y pseudobulbosas) de las bromeliáceas epífitas. Se muestrearon cinco tipos de vegetación: matorral de duna costera, manglar chaparro y tres tipos de selva. Encontramos una distribución desigual de los grupos entre los sitios de estudio. Un análisis asoció la abundancia diferencial de los grupos con variables ambientales relacionadas con la temperatura, el déficit de presión de vapor y la precipitación. Proponemos utilizar estas mediciones como línea base y continuar su monitoreo a largo plazo para registrar los efectos del cambio global sobre los ecosistemas. Palabras clave: bioindicadores; Bromeliaceae; grupos funcionales; neblina; rocío. |
The Yucatan Peninsula has the largest continuous tropical forest of Mexico, and one of the most extensive karst aquifers in the world. We propose the use of the functional groups of epiphytic bromeliads to monitor ecosystem health in the region. We measured their abundance in five ecosystems of the peninsula, coastal sand dune scrub, mangrove and three types of tropical forests. We found an uneven distribution of the five functional groups (C3 tank, CAM tank, shallow tank, nebulophyte and pseudobulbous) among the ecosystems. We related each group’s distribution to local climatic variables related to temperature, vapor pressure deficit and rain. We propose the use of the epiphyte distribution data generated as a baseline to study possible ecosystem alteration due to global change. Key words: bioindicators; Bromeliaceae; dew; functional groups; fog. |
Recibido: 24 de febrero de 2022.
Aceptado: 9 de marzo de 2023.
Introducción
En la península de Yucatán se localiza la selva tropical más conservada de México y la segunda más extensa a nivel continental, después de la Amazonía (Hansen et al., 2013; SEMARNAT, 2019; UNESCO, 2021). Además de este ecosistema, posee 60 % del total del área de manglar presente en el país (Velázquez-Salazar et al., 2021).
Manglares, selvas y matorrales de duna costera son hogares temporales de cerca de la mitad de las aves migratorias que cruzan el continente, siendo la península un punto importante de confluencia tras cruzar el Golfo de México (La Sorte et al., 2016). Estos ecosistemas regulan el clima de la región, manteniendo a uno de los acuíferos kársticos más extensos del planeta (Bauer Gottwein et al., 2011; GEY, 2013). Por estas razones, es muy relevante contar con un sistema para monitorear su salud.
El cambio global comprende las alteraciones de los procesos fundamentales que definen el funcionamiento del planeta derivados de la actividad humana, incluyendo el cambio climático y el uso de suelo que destruye los ecosistemas. Los ecosistemas naturales de la península de Yucatán son vulnerables a las modificaciones en el clima derivadas del calentamiento mundial, lo que puede exacerbar las temperaturas altas y la estacionalidad de las lluvias características de la zona (Orellana et al., 2009), así como la intensidad y frecuencia de huracanes y tormentas (GEY, BID, SEMARNAT, INECC, 2014). Además, los ecosistemas se encuentran sujetos a fuertes presiones debido al cambio de uso de suelo y la fragmentación originadas por la urbanización, la ganadería y el turismo, entre otras actividades (García Quintanilla et al., 2022), por lo que su degradación o los cambios ambientales repercutirán sobre la supervivencia y el desempeño de las especies localizadas en estos.
Para monitorear la salud de los ecosistemas, una metodología es el uso de especies indicadoras, también llamadas bioindicadores, que se caracterizan por reaccionar sensiblemente a los cambios en los parámetros que se desea dar seguimiento, como el régimen de precipitación o la temperatura (Siddig et al., 2016; Markert et al., 2003). De esta manera, el monitoreo de las poblaciones de bioindicadores a través del tiempo o espacio constituye un marcador efectivo de modificaciones en las variables de estudio. Las plantas de hábito epífito han sido propuestas para este propósito (Cach-Pérez et al., 2014; Krömer et al., 2014; Cristofolini et al., 2008; Davies et al., 2007). Las epífitas se definen como aquellas especies vegetales que llevan a cabo todo su ciclo de vida sobre una planta, la cual les sirve de sostén, sin tener contacto directo con los haces vasculares de esta, es decir, sin parasitarla (Zotz, 2016). Su función como bioindicadoras se propone debido a su desconexión con el suelo y, en consecuencia, a su acoplamiento con la atmósfera y con los pulsos de precipitación, que son su principal aporte de humedad, lo que las hace sensibles a cambios sutiles en el clima (Gignac, 2001; Zotz y Bader, 2009; Cach-Pérez et al., 2013).
Un ejemplo del uso de organismos con hábitos epífitos como bioindicadores es el empleo de líquenes para detectar la concentración de amonio atmosférico en ecosistemas mediterráneos (Pinho et al., 2011). En dicho estudio se clasificaron sus especies en grupos funcionales según su tolerancia a altas cantidades de nitrógeno. Al evaluar la distribución de sus poblaciones se encontró que aquellos cercanos a una fuente de amonio eran nitrofíticos, es decir, que soportan altas cantidades de ese elemento químico, mientras que sitios lejanos estaban dominados por los oligotróficos, para los que su exceso es tóxico. Esta distribución en el espacio se correlacionó con las mediciones de concentración de nitrógeno atmosférico. Dado que el conteo de los líquenes no requirió de sensores especializados, este se realizó con mayor cobertura y densidad de muestras, permitiendo tener un mapeo más detallado de la dispersión del nitrógeno en el espacio a partir de la fuente original. Lo anterior demuestra la ventaja del uso del marcador biológico sobre la utilización de sensores.
En el caso de las plantas epífitas de la familia Bromeliaceae, segunda de las angiospermas con mayor número de especies epífitas (Zotz, 2016) y compuesta por 3 709 de estas (Gouda et al., 2022), ocurre algo similar al ejemplo anterior. Las bromeliáceas han sido clasificadas en grupos funcionales que reflejan la interacción con su ambiente (Pittendrigh, 1948; Benzing, 2000; Reyes-García et al., 2022b).
En una clasificación reciente de Reyes-García y colaboradores (2022b), estas se dividen en cinco de acuerdo con su forma y en relación con su intercepción y uso de agua: 1) tanque C3, que se refiere a las especies con menor resistencia a la sequía (frecuentes en bosques lluviosos y de montaña) y presentan un tanque que se forma entre sus hojas dispuestas en una roseta, las cuales son no suculentas y con tamaños de medios a grandes (entre 0.2-1 m); 2) tanque CAM, en el que tienen receptáculos de tamaños grandes con una capacidad mayor a 61 ml, hojas gruesas y metabolismo ácido de las crasuláceas (CAM, por sus siglas en inglés), y se encuentran en sitios con lluvia intermedia (bosques de húmedos a estacionalmente secos); 3) tanque somero, la mayoría con fotosíntesis CAM, las cuales cuentan con tanques de baja capacidad y alta cobertura de tricomas foliares; 4) pseudobulbosas, que no presentan tanques, tienen una talla reducida y hojas suculentas que en su base forman un pseudobulbo, el cual puede albergar hormigas; y 5) nebulofitas, grupo donde las especies presentan hojas aciculares (muy delgadas y alargadas), no hay receptáculos y tienen alta cobertura de tricomas foliares.
Se han encontrado asociaciones entre los grupos funcionales de las bromeliáceas epífitas y los ecosistemas que habitan (Reyes-García et al., 2022b): las que presentan tanques profundos suelen estar en sitios más lluviosos y con menor demanda evaporativa; en contraste, las incluidas en tanque somero, pseudobulbosas y nebulofitas son más resistentes a la sequía, asociándose las primeras al uso de rocío, en particular durante el tiempo de secas (Andrade, 2003; Chávez Sahagún et al., 2019) y las últimas, al de la neblina (Martorell y Ezcurra, 2007; Reyes-García et al., 2008a; González et al., 2011; Reyes-García et al., 2012), mientras que las pseudobulbosas utilizan el agua almacenada en sus tejidos suculentos para sobrevivir a las sequías (Chávez-Sahagún et al., 2019).
Se espera que el uso de las bromeliáceas epífitas como bioindicadores, considerando los cinco grupos funcionales descritos, ayude a caracterizar elementos importantes del clima local, como la frecuencia de eventos de neblina o rocío, que favorecen a las nebulofitas o a las de tanque somero, respectivamente. Trabajos previos han encontrado una mayor cantidad de especies clasificadas como atmosféricas (que comprenden a tanque somero, pseudobulbosas y nebulofitas) en los sitios más calientes, secos y a menor elevación, en comparación con las de tipo tanque (comprendiendo a las C3 y CAM; Pittendrigh, 1948; Smith et al., 1986; Mejia-Chang et al., 2021). Estas investigaciones se han llevado a cabo en gradientes de precipitación elevada y zonas montañosas. Sin embargo, faltan estudios en partes bajas, con mucha más restricción de lluvia, como las que se encuentran en la mayoría de la República Mexicana y donde abundan los grupos funcionales nebulofitas y tanque somero.
Chilpa-Galván y colaboradores (2013) encontraron que, para una selva baja en la península de Yucatán, la abundancia de bromeliáceas epífitas se correlaciona con la disponibilidad de agua del subsuelo. En esa investigación, cambios muy sutiles en la humedad atmosférica, medidos con sensores localizados al interior del dosel en los sitios de estudio, resultaron en modificaciones sustanciales en la presencia de las bromeliáceas, resaltando la sensibilidad de estas especies.
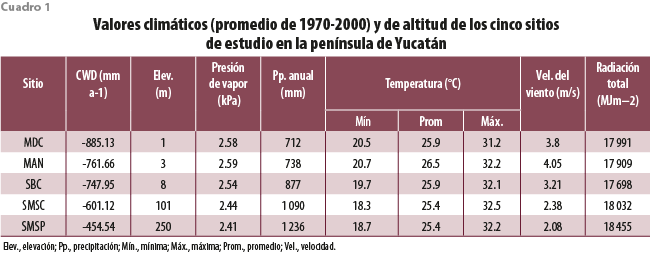
El presente trabajo tiene como objetivo obtener una línea base de la presencia y abundancia de especies epífitas, su agrupación en grupos funcionales y la relación de estos con las variables ambientales de cinco ecosistemas de la península de Yucatán: manglar chaparro (MAN), matorral de duna costera (MDC), selva baja caducifolia (SBC), selva mediana subcaducifolia (SMSC) y selva alta subperennifolia (SMSP), que se distribuyen en zonas de baja altitud, pero que representan un gradiente de precipitación anual que va de 712 a 1236 mm anuales. bit.ly/3P4Ch1p Se espera que esta línea base pueda servir como referencia en años futuros para evaluar los cambios ambientales en los ecosistemas.
Metodología
Sitios de estudio
Se llevaron a cabo muestreos de las poblaciones de bromeliáceas epífitas a lo largo de un gradiente de precipitación en la península de Yucatán, con una marcada estación seca (marzo a mayo), donde la mayoría de los árboles pierde sus hojas, seguida por una de lluvias (junio a octubre) y una seca temprana denominada nortes (noviembre a febrero), caracterizada por lluvias escasas y la formación de rocío (Orellana, 1999). Se eligieron los cinco tipos de vegetación (clasificación de Miranda y Hernández-Xolocotzi, 1963) arriba mencionados. Los sitios seleccionados presentan relativamente un buen estado de conservación y pertenecen a algún régimen de protección, con excepción del matorral de duna.
El MAN se localiza en la Reserva de la Biósfera Ría Celestún (20°59’47”N y 90°14’23”O); tiene un clima cálido y de transición entre el menos seco de los semiáridos BS1 (h’) w i y el menos húmedo de los subhúmedos Awo (i’) gw” (Orellana et al., 1999 y 2010). El sitio de estudio se encuentra en un área protegida de 81 432 ha, con una elevación de 3 metros sobre el nivel del mar (m s. n. m.) y una precipitación media anual de 675 mm; la altura promedio de dosel es entre 1.5 y 2.5 m (Cach-Pérez et al., 2013).
El MDC se ubica en la costa norte del estado de Yucatán, localidad de San Benito (21°19’21”N, 89°26’48”O), donde se presentan el subtipo climático BSo (h’) x’ i, o el más seco de los semiáridos, cálido, con lluvias intermedias o irregulares (Orellana et al., 1999 y 2010). En la vegetación de dunas costeras de la península de Yucatán se ha documentado la existencia de 271 especies vasculares, de las cuales 19 son endémicas de esa región (Durán García et al., 2010). El matorral conservado, donde se encuentra el sitio de estudio, está conformado por arbustos y árboles de poca altura (< 5 m).
La SBC se localiza en el Parque Nacional Dzibilchaltún (21°5'33.72"N y 89°36'0.36"O); tiene un clima Awo (i’) gw” o cálido, el más seco de los subhúmedos, con precipitaciones en verano y bajo porcentaje de lluvia invernal (Orellana et al., 1999 y 2010). El sitio de estudio se encuentra en una selva de vegetación secundaria regenerada, con una elevación de 10 m s. n. m. y una precipitación media anual de 838 a 1128 mm (SEMARNAT-CONANP, 2016). Esta vegetación está dominada por árboles, principalmente de la familia Fabaceae (leguminosas; González-Iturbe et al., 2002), de los cuales la mayoría pierde sus hojas durante la temporada de sequía; su estrato arbóreo no rebasa los 12 m de altura y la mayoría de los árboles pierde sus hojas durante la temporada de sequía.
La SMSC está en la Reserva Biocultural Kaxil Kiuic (20°5’22”N, 89°32’4”O); presenta el subtipo climático Ax’ (wo) (i’) gw o cálido subhúmedo, el más seco, con precipitaciones en verano y alto porcentaje de lluvia invernal (Orellana et al., 1999 y 2010). Esta selva, dominada por vegetación secundaria de diferentes edades, se extiende por 1 650 ha a 79 m de elevación, con una precipitación media anual de 1 150 mm; el dosel alcanza una altura promedio entre 10 y 15 m, y en la temporada de seca de 50 a 75 % de sus árboles dejan caer sus hojas; se desarrolla sobre suelos pedregosos, pero que contienen una delgada capa de materia orgánica (Flores-Guido et al., 2010).
La SMSP se ubica en la Reserva de la Biósfera Calakmul (18°36’43”N; 89°32’53”O); tiene un subtipo climático Ax’ (w1) w” o cálido subhúmedo intermedio, con precipitaciones uniformemente repartidas y tendencia a que sean en verano, con alto porcentaje de lluvia invernal y canícula (Orellana et al., 1999 y 2009); es un área de conservación de 713 185 ha., con una elevación de 230-380 m s. n. m. y una precipitación media anual de 1 500 mm; la altura del dosel es de 15 a 20 m y al menos 25 % deja caer sus hojas en la época seca (Cach-Pérez et al., 2013).
Muestreos
En el presente trabajo mostramos los datos poblacionales de las bromeliáceas epífitas obtenidos en el 2015 mediante muestreos dirigidos en parcelas permanentes de 10 × 10 m (Bakker et al., 1996; Reyes-García et al., 2008b; Corral-Rivas et al., 2013;). Debido a que las epífitas pueden ubicarse en parches definidos dentro de la vegetación, muestreos aleatorios pueden no ser muy efectivos para cuantificar su riqueza y abundancia en los sitios de estudio.
Para solventar esta situación, se realizaron recorridos para ubicar zonas donde las bromeliáceas fueran de abundantes a muy abundantes (> 15 % en los árboles que cuentan con éstas; CONAFOR, 2012). En estas áreas se establecieron cuadrantes de 10 × 10 m, dentro de los cuales se muestrearon todos los árboles y palmas (hospederos potenciales), limitándose en el caso de las selvas a ejemplares con un diámetro a la altura del pecho (DAP) mínimo de 4 cm para descartar plantas de talla pequeña. En el caso del manglar y la duna costera no hubo un tamaño mínimo de hospedero, ya que en estos sitios la mayoría de las plantas tienen una talla pequeña.
Se aseguró que los cuadrantes incluyeran a todas las especies que habían sido encontradas en exploraciones previas del sitio y mencionadas en la literatura local (Ramírez et al., 2004). Si bien es deseable que el número de parcelas sea igual en los diferentes tipos de vegetación, el esfuerzo de muestreo por parcela es diferencial, ya que en algunos tipos estas pueden contener mayor cantidad de hospederos y epífitas. Por lo anterior, el número de parcelas fue el mínimo posible para tener una buena representación de las comunidades de hospederos y epífitas, que se define usando curvas de acumulación de especies, en las cuales se buscó llegar a su asíntota (ver Cach-Pérez et al., 2013).
El número de cuadrantes[1] por sitio fue de tres en el manglar, tres en el matorral de duna costera, 11 en la selva baja caducifolia, 13 en la mediana subcaducifolia y seis en la mediana subperennifolia. Dentro de estos se marcaron todos los hospederos potenciales con etiquetas metálicas para facilitar el muestreo subsecuente. Las especies se identificaron con taxónomos y parataxónomos especialistas en el área y con ejemplares colectados para comparar con muestras depositadas en el Herbario del Centro de Investigación Científica de Yucatán (CICY).
Dentro de cada parcela y para cada hospedero marcado se censaron a simple vista todas las bromeliáceas epífitas, y en algunos casos con la ayuda de binoculares, por la altura de estas. Para su identificación, se utilizaron guías y ejemplares colectados para comparar con muestras del Herbario CICY (Ramírez et al., 2004). Los grupos funcionales se asignaron de acuerdo con Reyes-García y colaboradores (2022b).
El estadio de desarrollo en el que se encuentra la bromeliácea es importante dado que las plántulas muy pequeñas tienen altas tasas de mortalidad (Chilpa-Galván et al., 2017) y gran variación anual en sus poblaciones, siendo también una gran fuente de error durante el muestreo por ser poco visibles en estratos altos, así como en su identificación o agrupación por grupo funcional debido a que no hay desarrollo de un tanque o de toda la suculencia.
Por lo anterior, en el presente análisis solo se tomaron en cuenta las plantas maduras o adultas que ya han desarrollado su morfología funcional, aun cuando no sean reproductivas, lo que podría llevar varios años y puede derivar en la muerte del individuo o del ramet (hijuelo). Debido a que no se escalaron los árboles, las bromeliáceas no se marcaron individualmente, pero se registró, para cada una, la especie y el grupo funcional al que corresponde, su altura en el hospedero y el número de este para facilitar su ubicación en muestreos subsecuentes.
Variables ambientales
Para caracterizar el clima de los sitios de estudio, se obtuvieron de worldclim[2] (Fick y Hijmans, 2017) los promedios mensuales del periodo 1970-2000 de: presión de vapor de agua; precipitación total; temperaturas promedio, máxima y mínima; radiación solar; y velocidad del viento; así como los valores de altitud de los sitios de estudio. Si bien esta base de datos puede ser menos precisa que la información tomada en campo, permite acceder a datos de un largo periodo que caracterizan las condiciones atmosféricas, no disponibles para todos los lugares de interés en mediciones locales. Además, dichos datos se generan de interpolaciones de las estaciones climatológicas oficiales (CONAGUA) presentes en la zona, las cuales están distribuidas en toda la península de Yucatán agregando solidez a estos.
Análisis estadísticos
Para examinar si la abundancia de individuos de cada grupo funcional se distribuyó de manera aleatoria entre todos los sitios de estudio, se realizó una tabla de contingencia para obtener los datos esperados (e) que se compararon con los resultados de la tabla de datos observados (o) para conseguir un valor de X2 por medio de la fórmula ⅀ (o-e)2/e. Debido a que la cantidad de cuadrantes entre sitios fue diferente, no se utilizaron los números totales, sino el promedio de estos de cada lugar para la prueba.
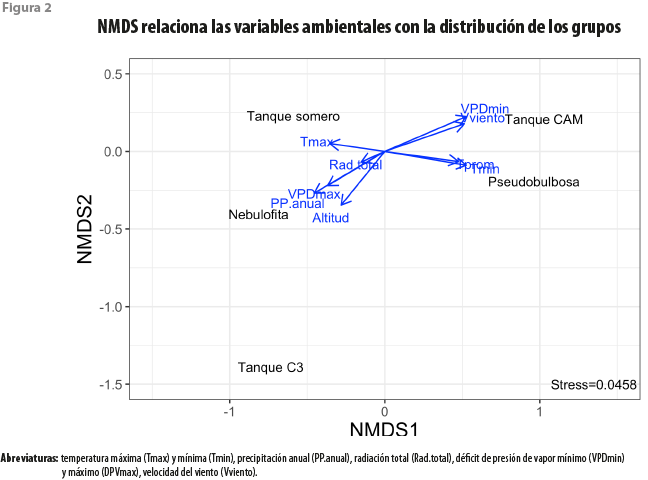
La relación entre las variables ambientales y la abundancia de los grupos funcionales se exploró usando un análisis no métrico de escalada multidimensional (nonmetric multidimensional scaling, NMDS) empleando el paquete vegan para R versión 3.4.0 (Oksanen et al., 2022). Este es útil al comparar datos con diferentes escalas y donde las relaciones entre ellos no son necesariamente lineales. La salida del NMDS se correlacionó con las variables ambientales de cada sitio para conocer su influencia sobre la abundancia de especies acorde con su grupo funcional; se utilizó la función envifit del mismo paquete vegan.
Resultados y discusión
El clima de los cinco sitios de estudio se diferenció principalmente por el monto de precipitación anual que se incrementa de manera progresiva del matorral de duna y el manglar hacia las selvas, siendo el gradiente de 712 a 1 236 mm anuales (cuadro 1). Las diferencias en la precipitación total anual se reflejaron también en el déficit hídrico climático (CWD, por sus siglas en inglés), revelando que los lugares más secos también presentan mayor déficit de precipitación-evapotranspiración, lo que representa un reto para la supervivencia de la mayoría de las plantas. La SMSP de Calakmul fue la menos expuesta a la sequía de los sitios de estudio. Esta selva también destacó por ser la que se encuentra a mayor altitud de estos (250 m s. n. m.). Tanto la radiación total como las temperaturas presentaron poca variabilidad entre sitios, aunque la temperatura mínima, importante para la condensación de agua atmosférica, fue menor en las SMSC y SMSP.
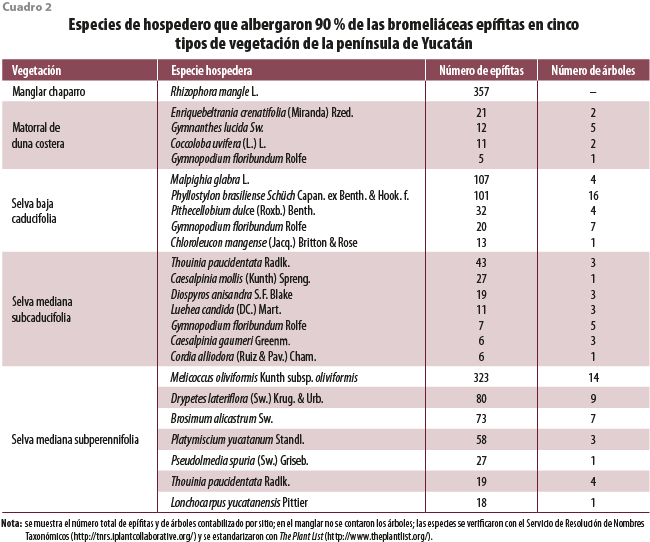
La diversidad de hospederos aumentó junto con el incremento en precipitación, del manglar más seco, donde 90 % de las epífitas se encuentran en Rhizophora mangle L. (la especie dominante en la zona), hasta las selvas medianas que presentaron, en ambos casos, siete especies de árboles como los hospederos principales. La preferencia por ciertas especies de hospederos puede observarse en el MDC, ya que de 14 especies reportadas (entre árboles, palmeras y arbustos; Cach-Pérez et al., 2013) solo cuatro albergaron a 90 % de las epífitas. En las selvas, entre cinco y ocho especies de árboles alojaban a 90 % de las epífitas, de un total de 27 a 31 especies de hospederos potenciales (cuadro 2). Además, destaca la gran cantidad de epífitas que se encontraron en Malpighia glabra L. y Phyllostylon brasiliense Schüch Capan. ex Benth. & Hook. f. para la SBC, Thouinia paucidentata Radlk. en la SMSC y Melicoccus oliviformis Kunth subsp. oliviformis en la SMSP.
Esta distribución desigual puede deberse a características como la rugosidad de la madera donde se anclan las epífitas (Hietz y Hietz‐Seifert, 1995), la apertura del dosel (Reyes-García et al., 2008a), a la cantidad de superficie disponible en ramas y troncos para la colonización (Cascante-Marín et al., 2006; Chilpa-Galván et al., 2013), a su fenología foliar (Zotz, 2016), entre otros factores. Es importante conocer las asociaciones hospedero-epífita, ya que los patrones poblacionales de los hospederos principales tendrán mayor repercusión sobre las poblaciones de las epífitas que las de hospederos potenciales donde no se encuentran estas con frecuencia.
En cuanto a la riqueza de bromeliáceas epífitas, se encontró que el lugar más húmedo, la selva mediana subperennifolia, obtuvo el mayor número de especies (10), mientras que el manglar, con menor precipitación anual, tuvo la menor diversidad (dos) (cuadro 3), lo cual coincide con lo reportado para epífitas y otros grupos de plantas (Gentry y Dodson, 1987; Adler y Levine, 2007; Kluge y Kessler, 2010). En los sitios de estudio de SMSC se registró un menor número de especies comparado con los de las SBC y SMSP, aun cuando esta selva tuvo una precipitación intermedia. La lista de especies revela que en la SMSC no se encuentran a las especies que requieren más lluvias, de hojas no suculentas, como Catopsis nutans (Sw.) Griseb., Tillandsia variabilis Schltdl. o T. polystachia (L.) L., pero también están ausentes las adaptadas a lugares con mayor radiación, como Tillandsia yucatana. La SBC, la más seca en cuanto a precipitación, presenta un mayor aporte de vientos húmedos y temperaturas mínimas debido a su cercanía a la costa, lo que puede promover la condensación de agua atmosférica, favoreciendo el establecimiento de un mayor número de epífitas. La SMSC representa parches de diferentes edades en regeneración, por lo que las especies reflejan las diferentes condiciones ecológicas de este heterogéneo ecosistema, donde se ha visto afectada la estructura de la comunidad arbórea, las condiciones ambientales y la disponibilidad de recursos que determinan el establecimiento de los grupos funcionales, y de cada especie de manera particular (Peterson, 1998).
Si bien esta investigación presenta la desventaja de tener un número desigual de cuadrantes en los tipos de vegetación comparados, las curvas de acumulación de especies demostraron que, para todos los sitios excepto el de la SMSC, se contabilizaron de 76 a 99 % de las especies, lo cual se considera óptimo (Jiménez-Valverde y Hortal, 2003; las curvas pueden consultarse en Cach-Pérez et al., 2013). En el caso de la SMSC, la curva de acumulación estimó que aún no se habían encontrado todas las especies. Sin embargo, dicha selva constituye un sitio intensivo de trabajo (ej. Saenz-Pedroza et al., 2020) por lo que se ha explorado extensivamente sin registrarse otras especies de bromeliáceas.
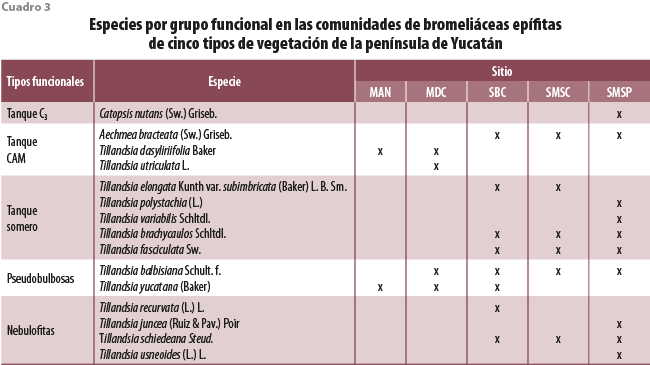
En la península se encontraron especies representantes de los cinco grupos funcionales, teniendo ejemplos de cada uno en la figura 1. Solamente las tanque CAM (representado con tres especies) se distribuyeron en los cinco tipos de vegetación; las tanque somero y las nebulofitas, que se restringieron a las selvas, presentaron el mayor número de especies (cinco y cuatro, respectivamente; cuadro 3). El grupo menos representado en los sitios fue el tanque C3, el cual tuvo una sola especie (Catopsis nutans) y se ubicó solo en la selva más húmeda, la SMSP.
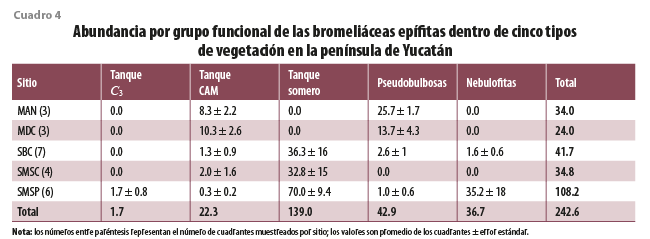
El análisis de las abundancias de los grupos por sitio encontró que la distribución no es al azar, siendo el valor de X2 obtenido de 247.3, el cual es mayor al de tablas de X2 α =0.05, g.l. = 16, 26.3 (cuadro 4). La SMSP fue la que presentó mayor número de individuos por cuadrante, así como de especies y representantes de los cinco grupos funcionales. Además de ser el único tipo de vegetación donde se observó una especie tanque C3, también se presentó el mayor número de especies del grupo nebulofitas. A diferencia de la SMSP, este grupo solo estuvo escasamente presente en las otras selvas, donde tuvo números muy bajos y estuvieron asociadas solo a ciertos cuadrantes.
El análisis con la técnica NMDS permitió conocer la asociación de las especies en grupos funcionales, así como su afinidad con las variables ambientales estudiadas. Arrojó un factor de Stress de 0.046, lo cual indica que el ajuste fue muy bueno. Las bromeliáceas del grupo nebulofitas son las más cercanas a las de tanque C3, el cual fue el más distante de los cinco (figura 2). Ambos grupos se relacionan con una mayor precipitación anual y elevación, y también negativamente con el déficit de presión de vapor mínimo (VPDmin). La mayor elevación favorece la formación de neblina, y este fenómeno sucede cuando el VPD se acerca a cero. En un trabajo a lo largo de un gradiente de elevación se observó que las nebulofitas se limitan a altitudes muy específicas (Martorell y Ezcurra, 2002).
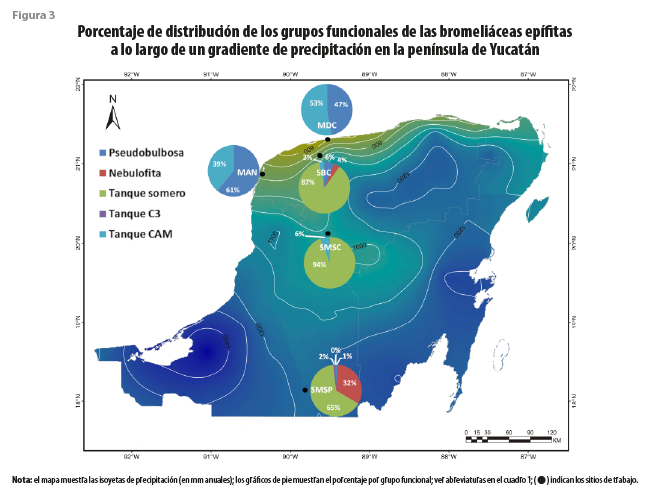
Tanque somero fue el grupo más abundante en las selvas de la península (cuadro 4), representando 87, 94 y 65 % de los individuos en las SBC, SMSC y SMSP, respectivamente (figura 3). Este grupo se ha identificado con los ambientes de altas temperaturas (Reyes-García et al., 2022b), lo cual concuerda con lo encontrado en el presente estudio, donde se asocia de manera positiva con las temperaturas máximas (Tmax, figura 2). Esta resistencia al elevado calor, que puede ser estresante para otras especies, podría explicar su abundancia en las selvas de esta área geográfica.
Las especies del grupo tanque somero se asociaron con el uso de rocío en la SBC de Dzibilchaltún (Andrade, 2003; Chávez-Sahagún et al., 2019), ya que sus receptáculos no almacenan grandes cantidades de agua y poseen una alta densidad de tricomas, en comparación con las de tanque CAM o C3, lo que les permite absorber eficientemente dicha condensación de agua sobre sus hojas. Es posible que esto, combinado con la transpiración nocturna característica de la fotosíntesis CAM, las haga menos susceptibles a la pérdida de agua por evaporación del tanque o por transpiración diurna. En los receptáculos con capacidades mayores, típicos de las bromeliáceas tanque CAM o C3, la evaporación del agua puede constituir un problema latente (Mejia-Chang et al., 2021). Por otro lado, las de tanque somero se relacionaron de forma negativa con la temperatura mínima (Tmin, figura 2), siendo que las bajas temperaturas nocturnas y la alta humedad relativa del aire al amanecer favorecen la condensación de rocío (Andrade 2003; Chávez-Sahagún et al., 2019).
Tanto las especies pseudobulbosas como las de tanque CAM se asociaron a las zonas costeras, siendo más abundantes en el manglar y el matorral de duna costera, en comparación con las selvas (cuadro 4). Las de tanque CAM fueron dominantes en el matorral, representando 54 % de los individuos (figura 3). Al estar asociadas a la costa, presentan una correlación positiva con la velocidad del viento (Vviento) y el VPDmin, así como una relación negativa con el VPDmax, lo cual favorecerá la baja evaporación del agua del receptáculo. Estas se asocian a sitios de baja elevación y de menor precipitación. Resalta que, en un estudio de especies de toda América tropical y subtropical, las especies de tanque CAM se asocian a una alta precipitación media anual, solo superada por las de C3 (Reyes-García et al., 2022b), lo cual puede respaldarse con listados de bosques de montaña, como los de Veracruz de Ignacio de la Llave, donde hay una alta presencia de especies de tanque CAM (Krömer et al., 2013). Sin embargo, ante la alta estacionalidad de la península de Yucatán y la baja precipitación en general, la baja evaporación del agua del receptáculo parece ser un elemento climático más relevante que la cantidad de lluvia. En un estudio comparativo de la especie de tanque CAM Tillandsia utriculata L., Rosado-Calderón y colaboradores (2020) encontraron que los individuos del MDC de Yucatán presentaban receptáculos más pequeños y menos abiertos que los ejemplares de la misma especie que habitan bosques de Chiapas, donde la lluvia es mayor y la evaporación menor. Estas modificaciones al tanque podrían contribuir a disminuir la disipación del agua almacenada, y la plasticidad en estos caracteres resalta su importancia en la prevención de la evaporación.
Por último, las especies del grupo pseudobulbosas fueron dominantes en el manglar con 61 % de los individuos (figura 3). Estas no se han asociado al uso de neblina ni rocío, sino que utilizan el agua de sus tejidos suculentos para subsistir cuando hay ausencia de lluvia (Chávez-Sahagún et al., 2019; Reyes-García et al., 2022b). Se encontraron asociadas a mayores temperaturas mínimas y medias, en comparación con las especies de los demás grupos. Si bien las de pseudobulbosas fueron escasas en las selvas, un estudio dentro de la misma reserva de Calakmul, donde muestreamos la SMSP, encontró que este grupo puede ser dominante en parches de selva secundaria (Reyes-García et al., 2022a).
Si bien la radiación total explica poco la distribución de los grupos, por su baja variación, esta variable representa el flujo de energía que llega arriba del dosel. La radiación incidente dentro de los microambientes de las copas de los árboles puede ser muy variable entre tipos de vegetación, con mayor radiación en los sitios más secos y abiertos (Cach-Pérez et al., 2013). En este caso, la SMSP de Calakmul es el lugar con más microhábitats sombreados dentro del estudio, lo cual puede no ser favorable para la mayoría de las bromeliáceas de pseudobulbosas, que se han asociado a sitios con alta radiación, mientras que los de selva secundaria donde las reportan llegan a ser muy abiertos.
Nuestros datos muestran una asociación entre el clima de cinco tipos de vegetación de la península de Yucatán, y los grupos funcionales, en concordancia con lo publicado previamente (Reyes-García et al., 2022b). Por esto, proponemos que el monitoreo a mediano y largo plazo de las abundancias de las epífitas, clasificadas dentro de los grupos funcionales, puede proveer valiosa información de cambios en los sistemas, no solo tomando en cuenta el clima local, sino la estructura y el grado de conservación del dosel (Reyes-García et al., 2022a).
Sugerimos que esta metodología podría ser utilizada en muchos ambientes más a lo largo de la República Mexicana donde las bromeliáceas son abundantes, incluyendo sitios más húmedos en los que las especies pueden ser más diversas. Por ejemplo, en los bosques húmedos de Los Tuxtlas, Veracruz de Ignacio de la Llave, que presentan una precipitación mayor a los 2 000 mm anuales, las especies listadas pertenecían en su mayoría al grupo tanque C3 (61 %), seguidas por las del CAM (13 %), mientras que los tres grupos restantes tuvieron entre 8 y 9 % de las especies (Krömer et al., 2013).
De acuerdo con lo anterior, puede apreciarse que al incrementar la precipitación cambian las especies presentes. Cabe resaltar que Higuera y Wolf (2010) encontraron que la riqueza de especies epífitas podría ser resiliente ante ciertos grados de disturbio antropogénico dentro de bosques de montaña, si bien sus datos demuestran que las abundancias de éstas están fuertemente influenciadas por esa perturbación. Por lo anterior, sería deseable que los estudios de los grupos se basaran en abundancias y no solo en la riqueza de especies.
Concluimos que la abundancia de las bromeliáceas epífitas y sus grupos funcionales pueden ser utilizados en la península de Yucatán para caracterizar los ambientes naturales. Al asociarse con variables climáticas y de forma potencial con variables estructurales del dosel, las abundancias pueden seguirse a través del tiempo como bioindicadores para evaluar si los ecosistemas locales han sido fuertemente transformados, ya sea por el cambio climático o por el de uso de suelo y la fragmentación, o si continúan siendo resilientes.
Fuentes
Adler, P. B. y J. M. Levine. “Contrasting relationships between precipitation and species richness in space and time”, en: Oikos. 116(2), 2007, pp. 221-232.
Andrade, J. L. “Dew deposition on epiphytic bromeliad leaves: an important event in a Mexican tropical dry deciduous forest”, en: Journal of tropical ecology. 19(5), 2003, pp.479-488.
Bakker, J. P., H. Olff, J. H. Willems y M. Zobel. “Why do we need permanent plots in the study of long‐term vegetation dynamics?”, en: Journal of Vegetation Science. 7(2), 1996, pp.147-156.
Bauer Gottwein, P., B. Gondwe, G. Charvet, L. E. Marín, M. Rebolledo Vieyra y G. Merediz-Alonso. “The Yucatán Peninsula karst aquifer, Mexico”, en: Hydrogeology Journal. 19(3), 2011, pp. 507-524.
Benzing, D. H. Bromeliaceae: Profile of an adaptive radiation. Cambridge, Reino Unido, Cambridge University Press, 2000, p. 710.
Cach-Pérez, M. J., J. L. Andrade, N. Chilpa-Galvan, M. Tamayo-Chim, R. Orellana y C. Reyes-García. “Climatic and structural factors influencing epiphytic bromeliad community assemblage along a gradient of water-limited environments in the Yucatan Peninsula, Mexico”, en: Tropical Conservation Science. 6, 2013, pp. 282-302.
Cach-Pérez, M. J., J. L. Andrade, y C. Reyes-García. “La susceptibilidad de las bromeliáceas epífitas al cambio climático”, en: Botanical Sciences. 92(2), 2014, pp.157-168.
Cascante-Marín, A., J. H. Wolf, J. G. B. Oostermeijer, J. C. M. Den Nijs, O. Sanahuja y A. Durán-Apuy, “Epiphytic bromeliad communities in secondary and mature forest in a tropical premontane area”, en: Basic and Applied Ecology. 7(6), 2006, pp. 520-532.
Chávez-Sahagún, E., J. L. Andrade, G. Zotz y C. Reyes-García. “Dew can prolong photosynthesis and water status during drought in some epiphytic bromeliads from a seasonally dry tropical forest”, en: Tropical Conservation Science. 12, 2019, pp. 1-11.
Chilpa-Galván, N., M. Tamayo-Chim, J. L. Andrade y C. Reyes-García. “Water table depth may influence the asymmetric arrangement of epiphytic bromeliads in a tropical dry forest”, en: Plant Ecology. 214(8), 2013, pp. 1037-1048.
Chilpa‐Galván, N., G. Zotz, G. J. Sánchez‐Fuente, C. Espadas‐Manrique, J. L. Andrade y C. Reyes‐García. “Drought, post‐dispersal seed predation, and the establishment of epiphytic bromeliads (Tillandsia spp.)”, en: Biotropica. 49(6), 2017, pp. 770-773.
Comisión Nacional Forestal (CONAFOR). Inventario Nacional Forestal y de Suelos, Manual y procedimientos para el muestreo de campo Re-muestreo 2011. Jalisco, México, CONAFOR, 2012, pp. 1-140.
Corral-Rivas, J. J., B. Vargas-Larreta, C. Wehenkel, O. A. Aguirre-Calderón y F. Crecente-Campo. Guía para el Establecimiento, Seguimiento y Evaluación de Sitios Permanentes de Monitoreo en Paisajes Productivos Forestales. México, CONAFOR-CONACYT, 2013, p.1-82.
Cristofolini, F., P. Giordani, E. Gottardini y P. Modenesi. “The response of epiphytic lichens to air pollution and subsets of ecological predictors: A case study from the Italian Prealps”, en: Environmental Pollution. 151, 2008, pp. 308-317.
Davies, L., J. W. Bates, J. N. B. Bell, P. W. James y O. W. Purvis. “Diversity and sensitivity of epiphytes to oxides of nitrogen in London”, en: Environmental Pollution. 146, 2007, pp. 299-310.
Durán García R., W. M. Torres Avilez y I. Espejel Carvajal. “Vegetación de dunas costeras”, en: Durán García R y M. Méndez (eds.). Biodiversidad y desarrollo humano en Yucatán. Mérida, México, CICY, PPD-FMAM, CONABIO, SEDUMA, 2010, pp-136-137.
Fick, S. E. y R. J. Hijmans. “WorldClim 2: new 1‐km spatial resolution climate surfaces for global land areas”, en: International Journal of Climatology. 37(12), 2017, pp. 4302-4315.
Flores-Guido, J. S., R. Durán-García y J. J. Ortiz Díaz. “Comunidades vegetales terrestres”, en: Durán R. y M. Mendez (eds). Biodiversidad y desarrollo humano en Yucatán. Mérida, México, CICY, PPD-FNAM, CONABIO, SEDUMA, 2010, pp. 125-129.
García Quintanilla, A., M. F. López Barreto, C. Espadas-Manrique, M. J. Cach-Pérez, J. A. Caballero Vázquez, C. Hernández Zepeda y C. Reyes-García. “Impact of the Tren Maya Megaproject on the Biocultural Heritage of the Mayan Area in Mexico´s Best Conserved Tropical Forest”, en: Int J Environ Sci Nat Res. 31(3), 2022, pp. 1-5.
Gentry, A. y C. Dodson. “Diversity and biogeography of neotropical vascular epiphytes”, en: Annals of the Missouri Botanical Garden. 74, 1987, pp. 205-233.
Gignac, L. D. “Bryophytes as Indicators of Climate Change”, en: The Bryologist. 104, 2001, pp. 410-420.
Gobierno del Estado de Yucatán (GEY). “Decreto 117. Decreto que establece el Área Natural Protegida denominada Reserva Estatal Geohidrológica del Anillo de Cenotes”, en: Diario Oficial del Gobierno del Estado de Yucatán (DOGEY). Yucatán, GEY, 2013 (DE) bit.ly/45ld88A, consultado el 10/11/2022.
GEY, BID, SEMARNAT, INECC. “Programa Especial de Acción ante el Cambio Climático del Estado de Yucatán”, en: Diario Oficial del Gobierno del Estado de Yucatán. Gobierno del Estado de Yucatán, 26 de abril de 2014.
González, A. L., J. M. Fariña, R. Pinto, C. Pérez, K. C. Weathers, J. J. Armesto y P. A. Marquet. “Bromeliad growth and stoichiometry: responses to atmospheric nutrient supply in fog-dependent ecosystems of the hyper-arid Atacama Desert, Chile”, en: Oecologia. 167(3), 2011, pp. 835-845.
González-Iturbe, J. A., I. Olmsted y F. Tun-Dzul. “Tropical dry forest recovery after long term Henequen (sisal, Agave fourcroydes Lem.) plantation in northern Yucatan, Mexico”, en: Forest Ecology and Management. 167(1-3), 2002, pp. 67-82.
Gouda, E. J., D. Butcher y C. S. Gouda. Encyclopaedia of Bromeliads, Versión 4. Utrecht, Países Bajos, Botanic Gardens, University Utrecht, 2022 (actualizado continuamente) (DE) bit.ly/3sga52P, consultado el 28/04/2022.
Hansen, M. C., P. V. Potapov, R. Moore, M. Hancher, S. A. Turubanova, A. Tyukavina, D. Thau, S. V. Stehman, S. J. Goetz, T. R. Loveland, A. Kommareddy, A. Egorov, L. Chini, C. O. Justice y J. R. G. Townshend. “High-Resolution Global Maps of 21st-Century Forest Cover Change”, en: Science. 342, 2013, pp. 850-853.
Hietz, P. y U. Hietz‐Seifert. “Composition and ecology of vascular epiphyte communities along an altitudinal gradient in central Veracruz, Mexico”, en: Journal of Vegetation Science. 6(4), 1995, pp. 487-498.
Higuera, D. y J. H. Wolf. “Vascular epiphytes in dry oak forests show resilience to anthropogenic disturbance, Cordillera Oriental, Colombia”, en: Caldasia. 32(1), 2010, pp. 161-174.
Jiménez-Valverde, A. y J. Hortal. “Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos”, en: Revista Ibérica de Aracnología. 8, 2003, pp.151-161.
Kluge, J. y M. Kessler. “Phylogenetic diversity, trait diversity and niches: species assembly of ferns along a tropical elevational gradient”, en: Journal of Biogeography. 38, 2010, pp. 394-405.
Krömer, T., J. G. García-Franco y T. Toledo-Aceves. “Epífitas vasculares como bioindicadores de la calidad forestal: impacto antrópico sobre su diversidad y composición”, en: González-Zuarth, C. A, A. Vallarino, J. C. Pérez-Jímenez y A. M. Low-Pfeng (eds.). Bioindicadores: guardianes de nuestro futuro ambiental. San Cristóbal de Las Casas, México, El Colegio de la Frontera Sur, Instituto Nacional de Ecología y Cambio Climático, 2014, pp. 605-623.
Krömer, T., A. Acebey, J. Kluge y M. Kessler. “Effects of altitude and climate in determining elevational plant species richness patterns: a case study from Los Tuxtlas, Mexico”, en: Flora-Morphology, Distribution, Functional Ecology of Plants. 208(3), 2013, pp. 197-210.
La Sorte, F. A., D. Fink, W. M. Hochachka y S. Kelling. “Convergence of broad-scale migration strategies in terrestrial birds”, en: Proceedings of the Royal Society B: Biological Sciences. 283(1823), 2016, pp. 1-9.
Markert, B. A., A. M. Breure y H. G. Zechmeister. “Definitions, strategies and principles for bioindication/biomonitoring of the environment”, en: Markert, B. A., A. M. Breure y H. G. Zechmeister (eds.). Bioindicators & Biomonitors: Principles, Concepts and Applications. Vol. 6. Oxford, Elsevier Science, 2003, pp. 3-39.
Martorell, C. y E. Ezcurra. “Rosette scrub occurrence and fog availability in arid mountains of Mexico”, en: Journal of Vegetation Science. 13, 2002, pp. 651-662.
_______ “The narrow-leaf syndrome: a functional and evolutionary approach to the form of fog-harvesting rosette plants”, en: Oecologia. 151, 2007, pp. 561-573.
Mejia-Chang, M., C. Reyes-García, U. Seibt, J. Royles, M. T. Meyer, G. D. Jones, K. Winter, M. Arnedo y H. Griffiths. “Leaf water δ18O reflects water vapour exchange and uptake by C3 and CAM epiphytic bromeliads in Panama”, en: Functional Ecology. 48(7), 2021, pp. 732-742.
Miranda, F. y E. Hernández-Xolocotzi. “Los tipos de vegetación de México y su clasificación”, en: Botanical Sciences. 28, 1963, pp. 29-179.
Oksanen, J., G. L. Simpson, F. Guillaume, R. Kindt, P. Legendre, P. R. Minchin, R. B. O'Hara, P. Solymos, M. H. H. Stevens, E. Szoecs, H. Wagner, M. Barbour, M. Bedward, B. Bolker, D. Borcard, G. Carvalho, M. Chirico, M. De Caceres, S. Durand, H. B. Antoniazi-Evangelista, R. FitzJohn, M. Friendly, B. Furneaux, G. Hannigan, M. O. Hill, L. Lahti, D. McGlinn, M. H. Ouellette, E. Ribeiro-Cunha, T. Smith, A. Stier, C. J. F. Ter Braak y J. Weedon. Vegan: Community Ecology Package. R package version 3.4.0. 2022 (DE) bit.ly/3KOnYLP consultado el 11/11/2022.
Orellana, R., C. Espadas y F. Nava. “Climas”, en: Durán, R. y M. Mendez (eds.). Biodiversidad y desarrollo humano en Yucatán. Mérida, México, CICY, PPD-FNAM, CONABIO, SEDUMA, 2010, pp. 10-11 (DE) bit.ly/3qFso0P.
Orellana, R., C. Espadas, C. Conde y C. Gay. Atlas escenarios de cambio climático en la península de Yucatán. Mérida, México, CICY, 2009, p. 111.
Orellana, R., E. García de Miranda, I. Bañuelos, M. Balam, J. A. González-Iturbe, F. Herrera y J. Vidal. “Climatología de la península de Yucatán (1961-1993)”, en: Chico-Ponce de León, P. y A. García de Fuentes (eds.). Atlas de procesos territoriales de Yucatán. Mérida, México, Universidad Autónoma de Yucatán, 1999, pp.163-182.
Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura (UNESCO, por sus siglas en inglés). Ancient Maya city and protected tropical forests of Calakmul, Campeche. México, UNESCO, 2021 (DE) bit.ly/47Gz93g consultado el 10/11/2022.
Peterson, G., C. R. Allen y C. S. Holling. “Ecological resilience, biodiversity, and scale”, en: Ecosystems. 1, 1998, pp. 6-18.
Pinho, P., T. Dias, C. Cruz, Y. Sim Tang, M. A. Sutton, M. A. Martins‐Loução y C. Branquinho. “Using lichen functional diversity to assess the effects of atmospheric ammonia in Mediterranean woodlands”, en: Journal of Applied Ecology. 48(5), 2011, pp. 1107-1116.
Pittendrigh, C. S. “The bromeliad-Anopheles-malaria complex in Trinidad. I- The bromeliad flora”, en: Evolution. 2, 1948, pp. 58-89.
Ramírez, I., G. Carnevali y F. Chi. Guía ilustrada de las Bromeliaceae de la porción mexicana de la península de Yucatán. Mérida, México, CICY, 2004, p. 124.
Reyes-García, C., C. Espadas Manrique, A. Dorantes, M. J. Cach-Pérez, N. A. Pereira-Zaldívar, R. Orellana y J. P. Pinzón-Esquivel. “Las bromeliáceas epífitas, ¿una fuente adicional de agua para vertebrados en selvas estacionales?” en: Desde el Herbario CICY. 14, 2022a, pp. 51-56.
Reyes-García, C., N. A. Pereira-Zaldívar, C. Espadas-Manrique, M. Tamayo-Chim, N. Chilpa-Galván, M. J. Cach-Pérez, M. Ramírez-Medina, A. M. Benavides, P. Hietz G. Zotz, J. L. Andrade, C. Cardelús, R. de Paula Oliveira, H. J. R. Einzmann, V. Guzmán Jacob, T. Krömer, J. P. Pinzón, J. Sarmento Cabral, W. Wanek y C. Woods. “New proposal of epiphytic Bromeliaceae functional groups to include nebulophytes and shallow tanks”, en: Plants. 11(22), 2022b, pp. 1-24.
Reyes‐García, C., M. Mejía-Chang, H. Griffiths, G. D. Jones y H. Griffiths. “Water vapour isotopic exchange by epiphytic bromeliads in tropical dry forests reflects niche differentiation and climatic signals”, en: Plant, Cell & Environment. 31(6), 2008a, pp. 828-841.
Reyes‐García, C., H. Griffiths, E. Rincón y P. Huante. “Niche differentiation in tank and atmospheric epiphytic bromeliads of a seasonally dry forest”, en: Biotropica. 40(2), 2008b, pp.168-175.
Reyes‐García, C., M. Mejia‐Chang y H. Griffiths. “High but not dry: diverse epiphytic bromeliad adaptations to exposure within a seasonally dry tropical forest community”, en: New Phytologist. 193(3), 2012, pp. 745-754.
Rosado‐Calderón, A. T., M. Tamayo‐Chim, E., de la Barrera, I. M. Ramírez‐Morillo, J. L. Andrade, O. Briones y C. Reyes‐García. “High resilience to extreme climatic changes in the CAM epiphyte Tillandsia utriculata L.(Bromeliaceae)”, en: Physiologia Plantarum. 168(3), 2020, pp.547-562.
Saenz-Pedroza, I., R. Feldman, C. Reyes-García, J. A. Meave, L. M. Calvo-Irabien, F. May-Pat y J. M. Dupuy. “Seasonal and successional dynamics of size-dependent plant demographic rates in a tropical dry forest”, en: PeerJ. 8, 2020, p. e9636.
Secretaría del Medio Ambiente y Recursos Naturales (SEMARNAT). Informe de la situación del medio ambiente en México, edición 2018. México, SEMARNAT, 2019, p. 487.
SEMARNAT-Comisión Nacional de Áreas Protegidas (CONANP). Programa de Manejo Parque Nacional Dzibilchaltún. México, CONANP, 2016, p. 176.
Siddig, A. A. Ellison, A. M. Ochs, A. C. Villar-Leeman y M. K. Lau. “How do ecologists select and use indicator species to monitor ecological change? Insights from 14 years of publication in Ecological Indicators”, en: Ecological Indicators. 60, 2016, pp. 223-230.
Smith, J. A. C., H. Griffiths y U. Lüttge. “Comparative ecophysiology of CAM and C3 bromeliads. I. The ecology of the Bromeliaceae in Trinidad”, en: Plant, Cell & Environment. 9(5), 1986, pp. 359-376.
Velázquez-Salazar, S., M. T. Rodríguez-Zúñiga, J. A. Alcántara-Maya, E. Villeda-Chávez, L. Valderrama-Landeros, C. Troche-Souza, B. Vázquez-Balderas, I. Pérez-Espinosa, M. I. Cruz-López, R. Ressl, D. V. G. De la Borbolla, O. Paz, V. Aguilar-Sierra, F. Hruby y J. H. Muñoa-Coutiño. Manglares de México. Actualización y análisis de los datos 2020. CDMX, México, CONABIO, 2021, p. 168.
Zotz, G. Plants on plants: the biology of vascular epiphytes. Basel, Switzerland, Springer Springer International Publishing, 2016, p. 272.
Zotz G. y M. Y. Bader. “Epiphytic plants in a changing world-global: Change effects on vascular and non-vascular epiphytes”, en: Progress in Botany. 70, 2009, pp.147-170.
[1] Las coordenadas de los cuadrantes permanentes pueden ser solicitadas a la autora para la correspondencia si van a ser utilizados con fines de investigación.